
TPE : Caloduc
Le Fluide caloporteur
Nous avons pu constater précédemment que le cuivre est l’un des meilleurs conducteurs thermiques, c’est donc pour cela qu’il est utilisé dans les caloducs. Cependant, nous nous sommes demandées, si le fait d’introduire un fluide dans un tube de cuivre pouvait améliorer sa capacité de transfert de chaleur.
A. Introduire de l’eau dans le tube de cuivre
-
Pourquoi l’eau ?
Tout d’abord, l’eau est un liquide qui peut varier à des températures allant de 0.1°C à 100°C selon la pression. C'est un fluide caloporteur chimiquement compatible avec le cuivre, de plus, il correspond aux plages de température évoquées ci-dessus.
L'eau est un fluide thermodynamique d'usage courant et efficace (chauffage, radiateur…)
mais également le plus conducteur des liquides (outre le mercure).
Il a une conductivité thermique 4 fois supérieure à d’autres liquides,
soit de 0.611 W/m/K (selon la loi de Fourier) à 25°C pour 1 atm.
Nous savons aussi que de par la vaporisation naturelle, l’eau s’évapore et se condense selon la température et la pression. On parle alors de vaporisation progressive. Nous nous sommes donc demandées si ce phénomène pouvait être utile pour améliorer le transfert de chaleur d’un échangeur thermique notamment en appliquant au "système eau + cuivre", une température de chauffe de 70°C.
Expérience
Nous avons donc réalisé une expérience afin de justifier l’utilité du principe d’évaporation et de condensation en introduisant de l'eau dans un tube de cuivre.
-
Expérience verre d’eau :
Matériel : - Verre d’eau
- Thermomètre sonde
Protocole : - Relever la température ambiante (19.7°C)
- Remplir un verre d’eau à température ambiante soit 19.7°C
Vidéo de l'éxperience du verre d'eau
-
Que s'est-il réellement passé ?
Lorsque l’on trempe le thermomètre sonde dans l’eau quelques secondes et qu’on le retire, la température chute (de 5°C environ). On remarque que la pellicule d’eau à la surface de la sonde est passée de l’état liquide à l’état vapeur. Le phénomène d'évaporation a donc eu lieu, on parle alors de vaporisation naturelle. Ceci nécessite donc de l’énergie pour se produire.
On peut retrouver ce phénomène dans la vie courante : un corps humide qui sort de la salle de bain après une douche chaude
a une sensation de froid car il y a une perte d’énergie due à l’évaporation de l’eau. L’eau sur la peau s’évapore ce
qui engendre une sensation de froid due à une absorption d’énergie.
-
En quoi est-ce utile dans un tube de cuivre isolé ?
Un principe de Lavoisier sur la conservation de l’énergie dans un système isolé démontre que : « Rien ne se perd, rien ne se crée, tout se transforme ». L’énergie totale d’un système isolé reste donc constante et équilibrée. Cela nous permet de conclure que la condensation restitue l’énergie alors que l’évaporation en absorbe.
Ainsi, lors de l’évaporation et de la condensation, il y a un transfert d’énergie qui s’effectue.
ZOOM sur le transfert d’énergie qui s’effectue entre l’évaporation et la condensation : les différentes structures moléculaires de l’eau.
-
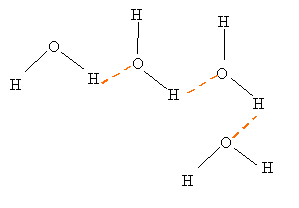
La molécule d’eau possède un dipôle électrique permanent, c'est donc pour cela que des liaisons hydrogène se créent entre les molécules. Les liens hydrogène aident les molécules d’eau à «se tenir» ensemble plus facilement :
- En phase gazeuse, les liaisons hydrogène sont inexistantes, les molécules se déplacent donc librement.
La disposition des molécules d’eau, dans les différentes phases, montre bien que lors de l’évaporation et de la condensation un transport d’énergie s’effectue. Il y a donc une absorption de chaleur quand les liaisons hydrogène se détachent et un dégagement de chaleur lorsqu’elles se forment.
Les différentes strctures des molécules d'eau :



Fluide caloporteur: fluide (gaz ou liquide) qui permet le transport de chaleur entre plusieurs sources de température.

- En phase liquide, les mouvements des molécules individuelles sont assez faibles pour que les liaisons hydrogène forcent les molécules à "se coller" entre elles mais d'une manière assez forte pour que la masse d'eau reste "mouvante" et non cristallisée comme la glace.
Molécule d'H2O
Liaisons hydrogène